|
[PRNewswire] Gan & Lee, 바이오시밀러 인슐린 1상 시험의 새로운 데이터 발표
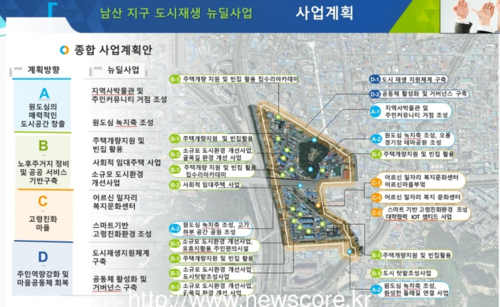
-- Aspart (GL-ASP), Lispro (GL-LIS) 및 Glargine (GL-GLA)의 신규 1상 시험 데이터, 제81회 미국당뇨병학회 학술회의에서 공개 (베이징 및 뉴저지주 브리지워터 2021년 7월 2일 PRNewswire=연합뉴스) Gan & Lee Pharmaceuticals Co., Ltd.(이하 Gan & Lee, 증권 코드: 603087.SH)가 지난달 25~29일에 열린 제81회 미국당뇨병학회(American Diabetes Association, ADA) 학술회의에서 긍정적인 1상 임상시험 결과를 발표했다. 새로운 데이터는 Gan & Lee가 제시한 세 가지 바이오시밀러 인슐린 유사체- insulin aspart (GL-ASP), insulin lispro (GL-LIS) 및 insulin glargine (GL-GLA)-에 대한 것이며, Profil(독일)의 주임 책임연구원이 발표했다. 세 건의 1상 연구 모두 일차 PK와 일차 PD 분석을 마쳤다. 연구 데이터 결과, Gan & Lee가 제안한 각 바이오시밀러 인슐린과 해당 참조 화합물 간에 약동학 및 약역학적 생물 등가성이 확인됐다. 그뿐만 아니라 Gan & Lee가 제안한 세 가지 바이오시밀러 인슐린과 각 참조 화합물 간의 안전성 특징도 유사한 것으로 나타났다.[1],[2],[3] 초록에 발표된 이 데이터는 Gan & Lee의 바이오시밀러 임상 개발 프로그램에서 중요한 이정표다. 2021년은 인슐린이 발견된 지 100주년이 되는 해다. 오늘날 인슐린 접근성은 여전히 세계적으로 건강상의 문제로 남아있다. Gan & Lee 임상 과학 이사 Jia Lu는 "세계적으로 당뇨병 부담 경감에 기여한다는 목표로, 바이오시밀러 인슐린을 임상 시행하는 데 한 발 더 다가가게 된 것을 기쁘게 생각한다"라고 언급했다. 세 건의 초록은 최근 Diabetes(R) 학술지 웹사이트에서 발표됐다. GL-ASP, GL-LIS 및 GL-GLA 초록의 포스터 발표 번호는 각각 738-P, 736-P 및 740-P다. Gan & Lee 소개 Gan & Lee는 중국에서 최초로 국산 생합성 인간 인슐린의 개발에 성공했다. 현재 Gan & Lee는 오래 지속되는 glargine 주사(Basalin(R)), 급속작용 lispro 주사(Prandilin(R)), 급속작용 aspart 주사(Rapilin™), 혼합 protamine zinc lispro 주사(25R)(Prandilin(R)25), aspart 30 주사(Rapilin™30), 재사용이 가능한 인슐린 주사펜(GanleePen™), 일회용 펜 니들(Ganlee Fine™)을 포함해 중국에서 다섯 개의 재조합형 인슐린 아날로그를 상업화했다. Gan & Lee는 장래에 당뇨병 진단과 치료 분야를 포괄하고, 심혈관 질환, 대사 질환, 암 및 기타 질병을 치료하는 새로운 화학물질을 개발하는 데 적극적으로 참여함으로써 세계적 수준의 제약업체가 되고자 하는 목표를 향해 노력하고 있다. 추가 정보는 이메일 investorrelations@ganlee.us 에 문의한다. 참고: 1. Leona Plum- Morschel, et. al. Proposed biosimilar insulin aspart (GL-ASP) shows pharmacokinetic (PK) and pharmacodynamic (PD) bioequivalence to US-licenced and EU-authorised insulin aspart. June 22, 2021. 2. Eric Zijlstra, et. al. Proposed biosimilar insulin lispro (GL-LIS) shows pharmacokinetic (PK) and pharmacodynamic (PD) bioequivalence to US-licenced and EU-authorised insulin lispro. June 22, 2021. 3. Tim Heise, et. al. Proposed biosimilar insulin glargine (GL-GLA) shows pharmacokinetic (PK) and pharmacodynamic (PD) bioequivalence to US-licenced and EU-authorised insulin glargine. June 22, 2021. Gina Antonucci 888-288-5395 investorrelations@ganlee.us 출처: Gan & Lee Pharmaceuticals Co., Ltd. New Data on Phase 1 Proposed Biosimilar Gan & Lee Insulins Aspart (GL-ASP), Lispro (GL-LIS), and Glargine (GL-GLA) Presented at the American Diabetes Association's 81st Scientific Sessions BEIJING and BRIDGEWATER, NJ., July 2, 2021 /PRNewswire/ -- Gan & Lee Pharmaceuticals Co., Ltd. (hereinafter referred to as Gan & Lee, stock code: 603087.SH), announced positive Phase 1 clinical trial results at the 81st Scientific Sessions of the American Diabetes Association (ADA), June 25th - 29th. The new data pertained to three proposed biosimilar Gan & Lee insulin analogs, insulin aspart (GL-ASP), insulin lispro (GL-LIS), and insulin glargine (GL-GLA), and were presented by the primary investigators from Profil, (Germany). All three phase 1 studies met their primary PK and primary PD analyses. These data demonstrate pharmacokinetic and pharmacodynamic bioequivalence between each of the proposed biosimilar Gan & Lee insulins and their respective reference compounds. In addition, the safety profiles were comparable between each of the three proposed biosimilar Gan & Lee insulins and their respective reference compounds1,2,3. The data presented from the abstracts, are a major milestone in the biosimilar clinical development programs at Gan & Lee. Although 2021 marks the centenary of insulin's discovery, insulin access remains a global health issue. "We are excited as we move one step closer to bringing biosimilar insulins into clinical practice with a goal of helping reduce the global burden of diabetes," said Jia Lu, Executive Director of Clinical Sciences. The three abstracts have recently been published on the journal Diabetes(R) website and the poster presentation numbers for the GL-ASP, GL-LIS, and GL-GLA abstracts are 738-P, 736-P, and 740-P, respectively. About Gan & Lee Gan & Lee has successfully developed the first domestic biosynthetic human insulin in China. Currently, the company has five recombinant insulin analogs and other products commercialized in China including long-acting glargine injection (Basalin(R)), fast-acting lispro injection (Prandilin(R)), fast-acting aspart injection (Rapilin™), mixed protamine zinc lispro injection (25R) (Prandilin(R)25) and aspart 30 injection (Rapilin™30), reusable insulin injection pen (GanleePen™), and disposable pen needle (Ganlee Fine™). Moving forward, Gan & Lee strives to advance its goal of becoming a world-class pharmaceutical company by providing a comprehensive coverage in the field of diabetes diagnosis and treatment, and also taking an active part in developing new chemical entities for the treatment of cardiovascular diseases, metabolic diseases, cancer, and other diseases. For more information, please contact us at investorrelations@ganlee.us. References: 1. Leona Plum- Morschel, et. al. Proposed biosimilar insulin aspart (GL-ASP) shows pharmacokinetic (PK) and pharmacodynamic (PD) bioequivalence to US-licenced and EU-authorised insulin aspart. June 22, 2021. 2. Eric Zijlstra, et. al. Proposed biosimilar insulin lispro (GL-LIS) shows pharmacokinetic (PK) and pharmacodynamic (PD) bioequivalence to US-licenced and EU-authorised insulin lispro. June 22, 2021. 3. Tim Heise, et. al. Proposed biosimilar insulin glargine (GL-GLA) shows pharmacokinetic (PK) and pharmacodynamic (PD) bioequivalence to US-licenced and EU-authorised insulin glargine. June 22, 2021. Gina Antonucci 888-288-5395 investorrelations@ganlee.us Source: Gan & Lee Pharmaceuticals Co., Ltd. [편집자 주] 본고는 자료 제공사에서 제공한 것으로, 연합뉴스는 내용에 대해 어떠한 편집도 하지 않았음을 밝혀 드립니다. (끝) 출처 : PRNewswire 보도자료 <저작권자 ⓒ 뉴스코어 무단전재 및 재배포 금지>
댓글
|
많이 본 기사
|